09月22日, 2014 182次
原电池教案(高中化学原电池构成)
原电池的构成、工作原理及应用
1.原电池的构成条件(1)两个活泼性不同的电极(燃料电池的两个电极活泼性可以相同)(2)负极上百思特网发生氧化反应,正极上发生还原反应。(3)利用电解质形成闭合回路。
【考向拓展】(1)电池的电极反应一定是氧化反应或还原反应,但电池总反应却不一定是氧化还原反应,如沉淀反应、中和反应等非氧化还原反应也可以设计成原电池;此外,利用离子浓度差也可以设计原电池,即“浓差电池”。(2)电解质既可以是电解质的水溶液,也可以是能传导离子的固体电解质,还可以是有机电解质溶液。
2.两种锌铜原电池的比较
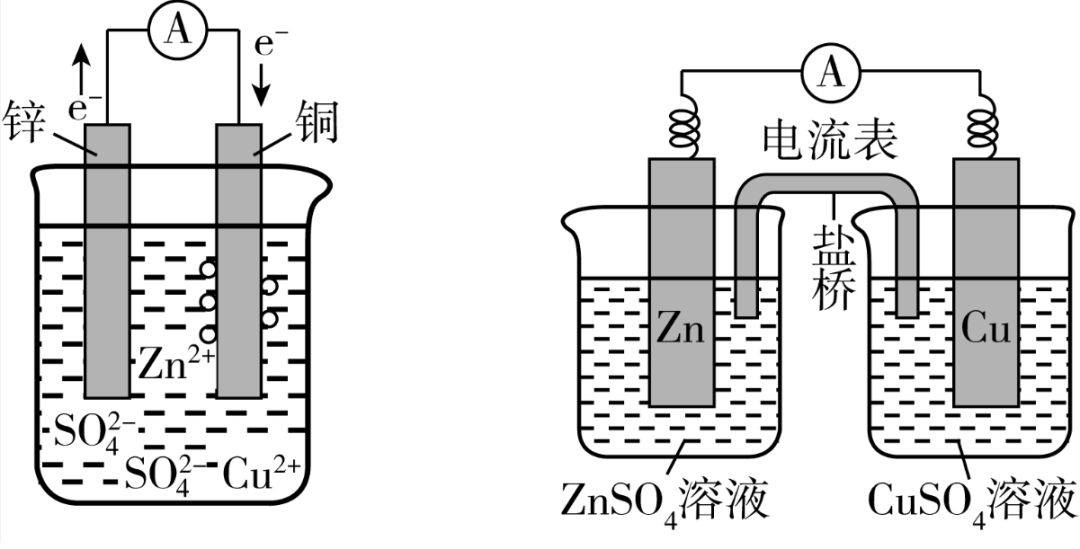
甲(一室电池) 乙(双室盐桥电池)
(1)一室电池的缺点:由于氧化剂与还原剂直接接触,工作一段时间后,锌片表面观察到有少量红色铜析出,说明锌片表面存在腐蚀电流,该电池的效率不高,电池不工作时,锌片继续被氧化,使得该电池的可贮存时间不长。(2)双室盐桥电池的优点:利用盐桥防止氧化剂与还原剂直接接触,提高电池效率、延长电池的可贮存时间。
”原电池原理深度分析
(1)铝铜浓硝酸电池
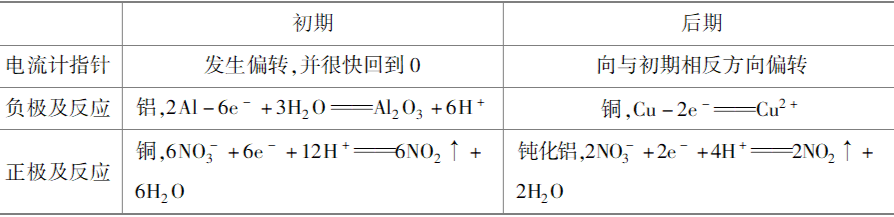
初期,活泼金属铝作负极被氧化,由于铝表面很快形成致密氧化物薄膜阻止反应继续百思特网进行,使铝钝化;电流计指针回到0后,铜作负极,钝化铝作正极,电流计指针向与初期相反的方向发生偏转。
(2)镁铝烧碱溶液电池
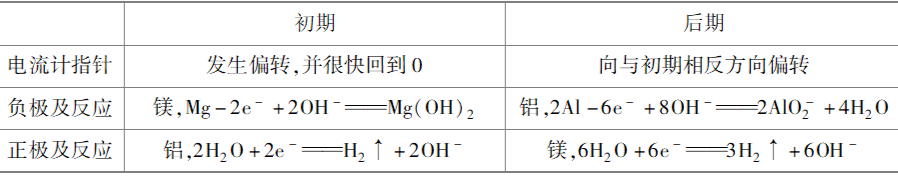
初期,活泼金属镁作负极被氧化,生成的氢氧化镁附着在镁电极上阻止反应继续进行,使镁钝化;电流计指针回到0后,铝作负极,镁作正极,电流计指针向与初期相反的方向发生偏转。
4.原电池原理在生活中的应用(1)用于金属的防护使被保护的金属制品(如海轮船壳)作原电池正极(阴极)而得到保护,镶嵌在金属制品表面的较活泼金属(如锌块)作原电池百思特网的负极(阳极)被腐蚀,即牺牲阳极的阴极保护法。(2)使变黑的银质器皿复原银质器皿久置,表面会生成Ag2S而逐渐变黑(4Ag+O2+2H2S=2Ag2S+2H2O),在铝质容器(作负极)中加入食盐溶液,再将变黑的银质器皿(作正极)浸入该溶液中,一段时间后,黑色的Ag2S会被还原为银白色的单质银,该法能使银质器皿无损耗复原。有关反应为负极反应:2Al-6e-=2Al3+;正极反应:3Ag2S+6e-=6Ag+3S2-;负极产生的Al3+与正极产生的S2-在溶液中继续反应:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑。









